, орг. соед. общей ф-лы RR'C=C=O, содержащие систему кумулированных двойных связей С=С и С=О. Различают альдокетены (R=Н, R' - opг. радикал) и кетокетены (R и R' - opг. радикал). Физ. св-ва К. представлены в таблице. СВОЙСТВА КЕТЕНОВ
| | | | | |
| | Соединение | Т. пл., °С | Т. кип.. o С | |
| | Кетен СН 2=C=О * | -151 | -56 | |
| | Метилкетен СН 3 СН= С= О | -80 | | |
| | Диметилкетен (СН 3)2 С= С=О | -97.5 | 34 | |
| | Диэтилкетен (C2H5)2C= С= О | | 92 | |
| | Дифенилкетен Ph2C= С=О | | 146 (11 мм рт. ст.) | |
| | | | | |
Х DН
0 обр - 47,729 кДж/моль. К. раств. в эфире, ароматических и хлорированных алифатич. углеводородах. ИК спектр имеет характеристич. полосы (в см
-1): 2200, 2080. К. легко присоединяют нуклеоф. реагенты:
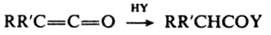
Y = ОН, ООН, OR:, SR:, NR
2:, R:COO, PR
2:, AsR
2: Аналогично протекает р-ция с минер, к-тами, а также с металлоорг. соед.; в последнем случае при гидролизе продуктов р-ции образуются соответствующие кетоны; напр.:
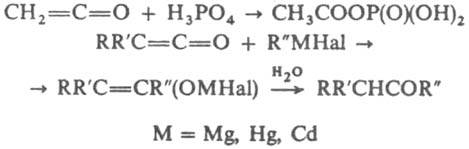
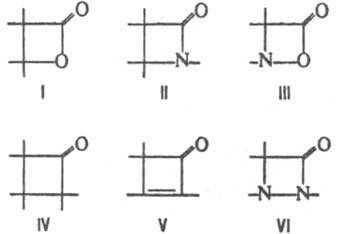
К. вступают в р-ции циклодимеризации с участием связей С=С и С=О. Кетен и альдокетены димеризуются в b-алкилиден-b-лактоны (дикетены), кетокетены - в производные циклобутан-1,3-диона:
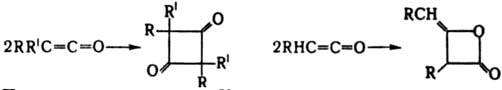
При циклодимеризации К. с соед., содержащими связи
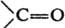
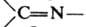
, -N=O,
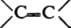
,

, - N=N-, образуются соотв. b-лактоны (ф-ла I), b-лактамы (II), 1,2-оксазетидиноны (III), производные циклобутанона (IV), циклобутенона (V) и 1,2-диазетидинона (VI):
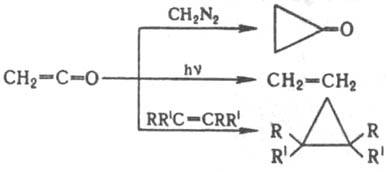
При р-ции кетена с диазометаном отщепляется азот и образуется циклопропанон (последний со второй молекулой диазометана превращ. в циклобутанон); при фотохим. разложении образуется карбен, к-рый димеризуется в этилен; при фотохим. р-ции с олефинами получаются циклопропаны:
Наиб, распространенные способы синтеза К.-дегалогенирование галогенангидридов a-галогенкарбоновых к-т, дегидрогалогенирование галогенангидридов к-т, содержащих атом водорода в а-положении, разложение диазокетонов (
Вольфа перегруппировка).,
напр.:
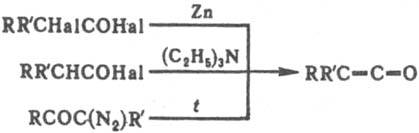
В пром-сти К. получают пиролизом карбонильных соед., в частности кетен из СН
3 СООН (при 700 °С в присут. триэтилфосфата), (СН
3 СО)
2 О или ацетона. В лаб. условиях кетен получают пиролизом дикетена при 700-800 °С. Металлоорг. производные К. получают взаимод. ацетатов Ag или Си с (СН
3 СО)
2 О в присут. пиридина, напр.: СН
3 СООМ + (СН
3 СО)
2 О:М
2 С=С=О М = Ag, Cu(I) Эти производные - катализаторы окислительных процессов. К. широко применяют для синтеза орг. соед.; кетен в качестве ацетилирующего агента для спиртов, аминов, енолъных форм кетонов, напр. в произ-ве ацетатов целлюлозы, а также для получения нек-рых орг. реагентов, напр. изопропенилацетата, b-пропиолактона, уксусного ангидрида, дикетена. По токсичности кетен приближается к фосгену. Для определения содержания его в воздухе применяют р-цию с гидроксиламином и превращение образующейся ацетилгидроксамовой к-ты в комплекс с Fe(III).
Лит.. Лейси Р. Н., в кн.. Успехи органической химии, т. 2, М., 1964, с. 204 254; Физер Л., Физер М.. Реагенты для органического синтеза, пер. с англ., т. 2, М., 1970. с. 125 29; Houben Weyl, Methoden der organischen Chemie, Bd 7, :П 4, Stuttg., 1968; The chemistry of functional groups. The chemistry of ketenes, allenes and related compounds, ed. by S. Patai, v. 1 2, Chichester, 1980.
С. И. Завьялов. В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно. Y = ОН, ООН, OR:, SR:, NR2:, R:COO, PR2:, AsR2: Аналогично протекает р-ция с минер, к-тами, а также с металлоорг. соед.; в последнем случае при гидролизе продуктов р-ции образуются соответствующие кетоны; напр.:
Y = ОН, ООН, OR:, SR:, NR2:, R:COO, PR2:, AsR2: Аналогично протекает р-ция с минер, к-тами, а также с металлоорг. соед.; в последнем случае при гидролизе продуктов р-ции образуются соответствующие кетоны; напр.: 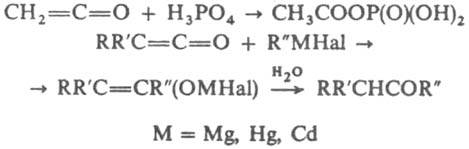 К. вступают в р-ции циклодимеризации с участием связей С=С и С=О. Кетен и альдокетены димеризуются в b-алкилиден-b-лактоны (дикетены), кетокетены - в производные циклобутан-1,3-диона:
К. вступают в р-ции циклодимеризации с участием связей С=С и С=О. Кетен и альдокетены димеризуются в b-алкилиден-b-лактоны (дикетены), кетокетены - в производные циклобутан-1,3-диона:  При циклодимеризации К. с соед., содержащими связи
При циклодимеризации К. с соед., содержащими связи 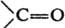
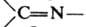 , -N=O,
, -N=O, 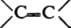 ,
,  , - N=N-, образуются соотв. b-лактоны (ф-ла I), b-лактамы (II), 1,2-оксазетидиноны (III), производные циклобутанона (IV), циклобутенона (V) и 1,2-диазетидинона (VI):
, - N=N-, образуются соотв. b-лактоны (ф-ла I), b-лактамы (II), 1,2-оксазетидиноны (III), производные циклобутанона (IV), циклобутенона (V) и 1,2-диазетидинона (VI):  При р-ции кетена с диазометаном отщепляется азот и образуется циклопропанон (последний со второй молекулой диазометана превращ. в циклобутанон); при фотохим. разложении образуется карбен, к-рый димеризуется в этилен; при фотохим. р-ции с олефинами получаются циклопропаны:
При р-ции кетена с диазометаном отщепляется азот и образуется циклопропанон (последний со второй молекулой диазометана превращ. в циклобутанон); при фотохим. разложении образуется карбен, к-рый димеризуется в этилен; при фотохим. р-ции с олефинами получаются циклопропаны:  Наиб, распространенные способы синтеза К.-дегалогенирование галогенангидридов a-галогенкарбоновых к-т, дегидрогалогенирование галогенангидридов к-т, содержащих атом водорода в а-положении, разложение диазокетонов (Вольфа перегруппировка)., напр.:
Наиб, распространенные способы синтеза К.-дегалогенирование галогенангидридов a-галогенкарбоновых к-т, дегидрогалогенирование галогенангидридов к-т, содержащих атом водорода в а-положении, разложение диазокетонов (Вольфа перегруппировка)., напр.:  В пром-сти К. получают пиролизом карбонильных соед., в частности кетен из СН 3 СООН (при 700 °С в присут. триэтилфосфата), (СН 3 СО)2 О или ацетона. В лаб. условиях кетен получают пиролизом дикетена при 700-800 °С. Металлоорг. производные К. получают взаимод. ацетатов Ag или Си с (СН 3 СО)2 О в присут. пиридина, напр.: СН 3 СООМ + (СН 3 СО)2 О:М 2 С=С=О М = Ag, Cu(I) Эти производные - катализаторы окислительных процессов. К. широко применяют для синтеза орг. соед.; кетен в качестве ацетилирующего агента для спиртов, аминов, енолъных форм кетонов, напр. в произ-ве ацетатов целлюлозы, а также для получения нек-рых орг. реагентов, напр. изопропенилацетата, b-пропиолактона, уксусного ангидрида, дикетена. По токсичности кетен приближается к фосгену. Для определения содержания его в воздухе применяют р-цию с гидроксиламином и превращение образующейся ацетилгидроксамовой к-ты в комплекс с Fe(III). Лит.. Лейси Р. Н., в кн.. Успехи органической химии, т. 2, М., 1964, с. 204 254; Физер Л., Физер М.. Реагенты для органического синтеза, пер. с англ., т. 2, М., 1970. с. 125 29; Houben Weyl, Methoden der organischen Chemie, Bd 7, :П 4, Stuttg., 1968; The chemistry of functional groups. The chemistry of ketenes, allenes and related compounds, ed. by S. Patai, v. 1 2, Chichester, 1980. С. И. Завьялов.
В пром-сти К. получают пиролизом карбонильных соед., в частности кетен из СН 3 СООН (при 700 °С в присут. триэтилфосфата), (СН 3 СО)2 О или ацетона. В лаб. условиях кетен получают пиролизом дикетена при 700-800 °С. Металлоорг. производные К. получают взаимод. ацетатов Ag или Си с (СН 3 СО)2 О в присут. пиридина, напр.: СН 3 СООМ + (СН 3 СО)2 О:М 2 С=С=О М = Ag, Cu(I) Эти производные - катализаторы окислительных процессов. К. широко применяют для синтеза орг. соед.; кетен в качестве ацетилирующего агента для спиртов, аминов, енолъных форм кетонов, напр. в произ-ве ацетатов целлюлозы, а также для получения нек-рых орг. реагентов, напр. изопропенилацетата, b-пропиолактона, уксусного ангидрида, дикетена. По токсичности кетен приближается к фосгену. Для определения содержания его в воздухе применяют р-цию с гидроксиламином и превращение образующейся ацетилгидроксамовой к-ты в комплекс с Fe(III). Лит.. Лейси Р. Н., в кн.. Успехи органической химии, т. 2, М., 1964, с. 204 254; Физер Л., Физер М.. Реагенты для органического синтеза, пер. с англ., т. 2, М., 1970. с. 125 29; Houben Weyl, Methoden der organischen Chemie, Bd 7, :П 4, Stuttg., 1968; The chemistry of functional groups. The chemistry of ketenes, allenes and related compounds, ed. by S. Patai, v. 1 2, Chichester, 1980. С. И. Завьялов.