(от лат. cohaesus - связанный, сцепленный), сцепление частей одного и того же однородного тела (жидкого или твердого). Обусловлена хим. связью между составляющими тело частицами (атомами, ионами) и межмол. взаимодействием. Работой К. наз. свободную энергию разделения тела на части и удаления их на такое расстояние, когда нарушается целостность тела. Работу К.
<>c определяют как работу обратимого изотермич. разрушения тела:
<>c=>2g, где g - уд. поверхностная энергия (для твердых тел) или поверхностное натяжение (для жидкостей). Соотношение
<>c и работы адгезии
<>a,> характеризующей сцепление разнородных тел (см.
Адгезия),
служит для определения способности жидкостей смачивать твердые тела: при
<>a <>1/
2<>c имеет место несмачивание, при
1/
2<>c<Wa<Wc -> смачивание, при
<>a>Wc растекание жидкости по пов-сти твердого тела. Широко используется также понятие плотности энергии К. E
с, к-рую отождествляют с внутр. энергией испарения (или сублимации) U
исп, отнесенной к молярному объему в-ва V
т:F
c=U
исп/V
m.
По значениям Е
с можно рассчитать параметр р-римости Гильдебранда 6:
<>c=>d
2 (см.
Растворимость).
Для низкомол. соед. энергию К. рассматривают как избыток потенц. энергии жидкости над потенц. энергией пара, численно равный внутр. энергии испарения Епри давлении ри т-ре
Т: 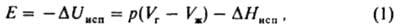
где DH
исп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния в-ва соответственно. При V
г>>V
ж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:

(Rгазовая постоянная). Значения Еи
Е с определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда DH
исп=0,02 Т
2 ксп+27,3Т
кип Ч2950. Приближенные расчеты
Е с основаны на предположении об аддитивности вкладов в плотность энергии К. энергий хим. связей, соединяющих атомы (инкрементов) DЕ
i: К. низкомол. в-в связана с их агрегатным состоянием
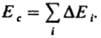
и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению
Е с от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп
Е с увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. При этом аналогично изменяются св-ва в-в (т-ры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие DH
исп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр р-римости полимера d
ВМС принимают равным параметру р-римости низкомол. жидкости, к-рая является для полимера лучшим р-рителем из всех имеющихся (о р-римости полимера судят по объемному набуханию или характеристич. вязкости р-ра). В случаях, если известна структурная ф-ла повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать
Е с,
используя метод инкрементов. Известно ок. 10 наборов значений DE
i позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5-10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Е
sc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, т-рами плавления и стеклования, характеристиками р-римости, набухания, смачиваемости, совместимости и др. св-в полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены
Е с увеличивается от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соотв., Е
sc изменяется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул,
Е с достигает 350, а Е
sc -50000-70000 кДж/моль. Дальнейшее углубление представлений о К. предполагает рассмотрение отдельных составляющих плотности энергии К. (параметра р-римости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (d
р),
дисперсионным взаимодействием(d
d)
и
водородной связью(d
Н). Общее (суммарное) значение параметра р-римости d
S определяется соотношением:
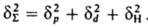
Для воды значение d
S определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (d
Н=34,2, d
р=31,3,d
d=12,3 МДж
0,5/м
1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами d
р соотв. в 2 и 5-10 раз больше, чем для незамещенных углеводородов. Для техн. углерода d
d=21,1, d
р=12,3, d
Н=11,2 МДж
0,5/м
1,5. Для полимеров отдельные составляющие d
S выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп.
Лит. Аскадский А А., Матвеев Ю И., Химическое строение и физические свойства полимеров, М., 1983; Вакула В Л., Притыкин Л М, Физическая химия адгезии полимеров, М, 1984; Притыкин Л М и др., "Высокомолекулярные соединения", 1985. т 27А, № 1, с. 24 9; 1663 75, Роул и неон Д. Ш.. Уидом Б., Молекулярная теория капиллярности, пер с англ., М , 1986; Garden J L, "J Colloid and Interfase So.", 1977, v 59, № 3. 582 96.
Л М Притыкин В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.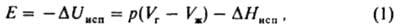 где DH исп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния в-ва соответственно. При V г>>V ж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:
где DH исп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния в-ва соответственно. При V г>>V ж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:  (Rгазовая постоянная). Значения Еи Е с определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда DH исп=0,02 Т 2 ксп+27,3Т кип Ч2950. Приближенные расчеты Е с основаны на предположении об аддитивности вкладов в плотность энергии К. энергий хим. связей, соединяющих атомы (инкрементов) DЕ i: К. низкомол. в-в связана с их агрегатным состоянием
(Rгазовая постоянная). Значения Еи Е с определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда DH исп=0,02 Т 2 ксп+27,3Т кип Ч2950. Приближенные расчеты Е с основаны на предположении об аддитивности вкладов в плотность энергии К. энергий хим. связей, соединяющих атомы (инкрементов) DЕ i: К. низкомол. в-в связана с их агрегатным состоянием 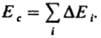 и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Е с от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Е с увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. При этом аналогично изменяются св-ва в-в (т-ры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие DH исп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр р-римости полимера d ВМС принимают равным параметру р-римости низкомол. жидкости, к-рая является для полимера лучшим р-рителем из всех имеющихся (о р-римости полимера судят по объемному набуханию или характеристич. вязкости р-ра). В случаях, если известна структурная ф-ла повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Е с, используя метод инкрементов. Известно ок. 10 наборов значений DEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5-10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Е sc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, т-рами плавления и стеклования, характеристиками р-римости, набухания, смачиваемости, совместимости и др. св-в полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Е с увеличивается от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соотв., Е sc изменяется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Е с достигает 350, а Е sc -50000-70000 кДж/моль. Дальнейшее углубление представлений о К. предполагает рассмотрение отдельных составляющих плотности энергии К. (параметра р-римости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (d р), дисперсионным взаимодействием(dd) и водородной связью(d Н). Общее (суммарное) значение параметра р-римости dS определяется соотношением:
и служит для оценки св-в (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Е с от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Е с увеличивается соотв. до 20-60, 11-30 и 22-35 кДж/моль. При этом аналогично изменяются св-ва в-в (т-ры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие DH исп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр р-римости полимера d ВМС принимают равным параметру р-римости низкомол. жидкости, к-рая является для полимера лучшим р-рителем из всех имеющихся (о р-римости полимера судят по объемному набуханию или характеристич. вязкости р-ра). В случаях, если известна структурная ф-ла повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Е с, используя метод инкрементов. Известно ок. 10 наборов значений DEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5-10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Е sc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, т-рами плавления и стеклования, характеристиками р-римости, набухания, смачиваемости, совместимости и др. св-в полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Е с увеличивается от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соотв., Е sc изменяется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Е с достигает 350, а Е sc -50000-70000 кДж/моль. Дальнейшее углубление представлений о К. предполагает рассмотрение отдельных составляющих плотности энергии К. (параметра р-римости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (d р), дисперсионным взаимодействием(dd) и водородной связью(d Н). Общее (суммарное) значение параметра р-римости dS определяется соотношением: 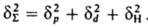 Для воды значение dS определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (d Н=34,2, d р=31,3,dd=12,3 МДж 0,5/м 1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами d р соотв. в 2 и 5-10 раз больше, чем для незамещенных углеводородов. Для техн. углерода dd=21,1, d р=12,3, d Н=11,2 МДж 0,5/м 1,5. Для полимеров отдельные составляющие dS выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп. Лит. Аскадский А А., Матвеев Ю И., Химическое строение и физические свойства полимеров, М., 1983; Вакула В Л., Притыкин Л М, Физическая химия адгезии полимеров, М, 1984; Притыкин Л М и др., "Высокомолекулярные соединения", 1985. т 27А, № 1, с. 24 9; 1663 75, Роул и неон Д. Ш.. Уидом Б., Молекулярная теория капиллярности, пер с англ., М , 1986; Garden J L, "J Colloid and Interfase So.", 1977, v 59, № 3. 582 96. Л М Притыкин
Для воды значение dS определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (d Н=34,2, d р=31,3,dd=12,3 МДж 0,5/м 1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами d р соотв. в 2 и 5-10 раз больше, чем для незамещенных углеводородов. Для техн. углерода dd=21,1, d р=12,3, d Н=11,2 МДж 0,5/м 1,5. Для полимеров отдельные составляющие dS выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп. Лит. Аскадский А А., Матвеев Ю И., Химическое строение и физические свойства полимеров, М., 1983; Вакула В Л., Притыкин Л М, Физическая химия адгезии полимеров, М, 1984; Притыкин Л М и др., "Высокомолекулярные соединения", 1985. т 27А, № 1, с. 24 9; 1663 75, Роул и неон Д. Ш.. Уидом Б., Молекулярная теория капиллярности, пер с англ., М , 1986; Garden J L, "J Colloid and Interfase So.", 1977, v 59, № 3. 582 96. Л М Притыкин