Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Натрия Тиосульфат
Na2S2O3, бесцв. кристаллы; существует в трех модификациях: a с моноклинной решеткой ( а =0,8513 нм, b =0,8158 нм, с =0,6425 нм, b = 97,08 °, z =4,пространств. группа P2i/c, плотн. 2,345 г/см 3), b и g; т-ры переходов a
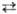 b 330 °С, b
b 330 °С, b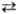 g 380 °С; DH0 обр (a) Ч1136 кДж/моль. При нагр. в вакууме до 300 °С разлагается на Na2SO3 и S. На воздухе устойчив до 80 °С. Р-римость в воде (г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С). Плотн. водных р-ров (г/см 3) при 20 °С: 1,1740 (20% по массе Н. т.), 1,3827 (40%). Из водных р-ров при 11-48°С кристаллизуется пентагидрат - бесцв. кристаллы с моноклинной решеткой; т. пл. 48,5 °С (с разл.); плотн. 1,715 г/см 3; С 0 р >360,7 Дж/моль; DH0 пл 23,4 кДж/моль, DH0 о6р - 2622,69 кДж/(моль . К); S0298 313,5 Дж/(моль . К). Получены ди- и гемигидраты, плавящиеся инконгруэнтно соотв. при 65,5 и 74 °С, а также метастабильные тетра- и гексагидраты. Н. т.-восстановитель; сильные окислители (напр., Сl2) окисляют его до Na2SO4, слабые (напр., I2 в нейтральных р-рах)-до Na2S406.
g 380 °С; DH0 обр (a) Ч1136 кДж/моль. При нагр. в вакууме до 300 °С разлагается на Na2SO3 и S. На воздухе устойчив до 80 °С. Р-римость в воде (г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С). Плотн. водных р-ров (г/см 3) при 20 °С: 1,1740 (20% по массе Н. т.), 1,3827 (40%). Из водных р-ров при 11-48°С кристаллизуется пентагидрат - бесцв. кристаллы с моноклинной решеткой; т. пл. 48,5 °С (с разл.); плотн. 1,715 г/см 3; С 0 р >360,7 Дж/моль; DH0 пл 23,4 кДж/моль, DH0 о6р - 2622,69 кДж/(моль . К); S0298 313,5 Дж/(моль . К). Получены ди- и гемигидраты, плавящиеся инконгруэнтно соотв. при 65,5 и 74 °С, а также метастабильные тетра- и гексагидраты. Н. т.-восстановитель; сильные окислители (напр., Сl2) окисляют его до Na2SO4, слабые (напр., I2 в нейтральных р-рах)-до Na2S406. Н. т. получают р-цией S с р-ром Na2SO3, взаимод. H2S и SO2 с р-ром NaOH, р-цией NaHS (либо Na2S2) с NaHSO3 или Na2S с SO2 и Na2CO3, как побочный продукт в произ-ве NaHSO3, сернистых красителей, при очистке пром. газов от S. Применяют Н. т. для удаления хлора при отбеливании тканей, как закрепитель в фотографии, реактив в иодомет-рии, противоядие при отравлении соед. Hg, As и др., противовоспалит. ср-во.
Лит. см. при ст. Натрия сульфит. Л. Н. Куликова.