Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Неравновесная Химическая Кинетика
изучает кинетич. закономерности хим. р-ций при сильном нарушении термодинамич. равновесия в реагирующей системе или физ.-хим. среде, в к-рой они протекают. Любая хим. р-ция нарушает термодинамич. равновесие в системе, но во мн. случаях это нарушение мало, и если нет внеш. источников возмущения состояния системы, то при кинетич. расчетах неравновесностью либо пренебрегают, либо учитывают как второстепенный фактор, вводя малые поправки к константам скорости р-ций. В таких случаях говорят о р а в н о в е с н о й к и н е т и к е (условно, поскольку хим. состав системы должен быть неравновесным, иначе скорости всех р-ций были бы равны нулю). Константы скорости в равновесной кинетике выражаются в виде ф-ций от термодинамич. параметров среды, напр. т-ры и давления.
В условиях термодинамич. равновесия относит. заселенность i-го энергетич. уровня <>i /N >(N-полное число молекул, <>i Ч> число молекул на энергетич. уровне <>i )зависит от т-ры Токружающей среды и описывается ф-л о й Б о л ь ц-м а н а:
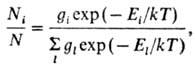
где k-постоянная Больцмана,
i, gl-> числа возможных квантовых состояний молекулы на уровнях с энергиями Е i и Е l соотв. (суммирование проводится по индексу l). Если оператор энергии (гамильтониан) системы допускает разделение переменных, то энергию Е i можно выразить в виде суммы энергий независимых или слабо связанных подсистем. В газах Е i можно представить в виде суммы энергий поступат. и вращат. движений молекул, внутримол. колебаний и электронного возбуждения, причем каждый вид энергии описывается своей ф-цией распределения типа ф-лы Больцмана.При отклонении от равновесия все или нек-рые из распределений частиц по энергиям типа больцмановского не реализуются. Это может приводить к качеств. и количеств. изменениям кинетики р-ций. Не существует признаков, позволяющих разделить хим. кинетику на неравновесную и равновесную. Строго судить об этом нельзя ни по величине относит. отклонения заселенности конкретных энергетич. уровней от равновесной заселенности <>i /N,> ни по числу таких уровней, ни по отличию константы скорости р-ции от ее равновесного значения и т. п. В общем случае можно говорить только об условных границах в зависимости от требуемой точности решения конкретной кинетич. задачи. Однако по мере удаления от таких "размытых" границ признаки неравновесных хим. р-ций становятся все более определенными и м. б. установлены на основе общих качеств. сопоставлений характерных времен релаксационных процессов в газах и конденсир. средах (т. е. по иерархии времен релаксации). Система, выведенная из состояния тер-модинамич. равновесия, возвращается к нему (релаксирует) в результате обмена энергией при столкновениях частиц неравномерно, с перераспределением по типам движений (степеням свободы молекулы). В газах равновесие м. б. достигнуто быстрее всего для поступат. движения частиц, имеющих одинаковые (или близкие по величине) массы. Колебат. движение, как правило, не обменивается энергией с поступат. движением в процессе столкновения. Молекула может претерпеть значит. число столкновений, прежде чем она приобретет или потеряет квант колебат. энергии. Обычно в системе сначала устанавливается общее равновесие поступат. и вращат. движений. Колебат. релаксация, ведущая к равновесию колебаний молекул с их поступат. и вращат. движениями, требует значительно большего времени.
Если в газовой смеси имеются частицы, на порядки величин различающиеся по массам, время установления поступат. равновесия для смеси в целом гораздо больше, чем для отдельных компонент осн. состава (но не малых примесей). В ионизир. газе вследствие огромного различия масс электронов и атомов задолго до завершения поступат. релаксации устанавливаются равновесия отдельно в подсистемах "тяжелых" частиц (атомов и ионов) и электронов с двумя в общем случае разными т-рами, соотв. Т a пост и Т эл пост. В процессе колебат. релаксации до его завершения в зависимости от состава смеси и типа колебаний могут устанавливаться равновесия по отдельным группам колебат. степеней свободы (колебат. подсистемам), каждое со своей т-рой Т кол, и между такими группами.
Таким же соотношением (иерархией) времен релаксации характеризуются мол. жидкости и мол. кристаллы, с тем, однако, отличием, что в жидкостях поступат. и вращат. движения молекул составляют обычно единое целое (энергии этих видов движения можно разделить лишь в очень грубом приближении). В твердых телах все движения атомов и молекул колебательные.
Равновесие по хим. составу, к к-рому приводят хим. р-ции, как правило, достигается за времена, значительно большие по сравнению со временем колебат. релаксации. Однако при достаточно высоких т-рах константы скорости р-ций сильно возрастают как по абс. величине (см. Аррениуса уравнение), так и в сравнении с временами др. релаксационных процессов, и в системе создаются условия, при к-рых возмущения, вызываемые хим. р-цией, релаксировать не успевают. Это относится в особенности к релаксации тех энергетич. состояний, от заселенности к-рых зависит скорость р-ции. В результате скорость р-ции становится зависящей от времен колебат. релаксации, а иногда, в предельных случаях сильной неравновесности, и от времен вращат. и поступат. релаксаций. Иными словами, устанавливается отрицат. обратная связь между скоростью р-ции и теми возмущениями, к-рые она вызывает, что можно рассматривать как одно из проявлений Ле Шателье- Брауна принципа. Зависимость скорости р-ции от Т пост становится при этом более слабой. Так, в сильных ударных волнах константа диссоциации при высоких Т пост (в условиях kTnocт>= D/17, где D- энергия диссоциации) обычно выражается соотношением
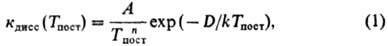
где показатель степени ппринимает значения от 1 до 4, A-эмпирич. постоянная.
Количеств. соотношения Н. х. к., как правило, значительно сложнее, чем равновесной. Кроме кинетич. ур-ний для концентраций реагирующих в-в и продуктов приходится иметь дело и с ур-ниями, выражающими временные зависимости для заселенностей возбужденных состояний частиц. Такие системы ур-ний, в принципе, можно решать на ЭВМ, если имеются данные о константах скорости элементарных процессов мол. переноса энергии - колебательно-вращательного, колебательно-поступательного (колебательно-трансляционного) и вращательно-трансляционного. В сильно неравновесных условиях решение задач Н. х. к. обеспечивается не столько возможностью решения полной системы ур-ний для заселенностей всех энергетич. состояний частиц, сколько правильным выделением "узкого места" в совокупности элементарных актов, из к-рых слагается хим. превращение. Для этого нужно определить наиб. быстрые параллельные и наиб. медленные последовательные переходы и вычислить (или измерить) их константы скорости - величины, обратные временам жизни молекул в соответствующих возбужденных состояниях.
Вычисление констант скорости хим. р-ций упрощается, если в неравновесной в целом системе можно выделить равновесные подсистемы. Константы скорости р-ций в таких случаях выражаются как ф-ции т-р подсистем. Напр., константа скорости диссоциации к AB дисс двухатомного газа АВ при высоких T пост приближенно представляется в виде ф-лы типа (1), но в экспоненциальный множитель вместо Т пост входит Т кол, а предэкспоненциальный множитель слабо зависит от т-ры. Т. к. движение атомов в молекуле носит в осн. колебат. характер, а кинетика многих хим. превращений связана именно с внутримол. перемещениями атомов, т-ра Т кол- важнейшая кинетич. и энергетич. характеристика состояния газа в условиях, описываемых Н. х. к. Для молекул, состоящих из неск. атомов, константа скорости мономол. распада м. б. при низких давлениях экспоненц. ф-цией Т пост и T кол, общей для всех колебаний (иногда отдельно рассматриваются Т кол для низко- и высокочастотных колебаний).
В случае р-ций с участием электронов (ионизация А + е
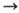 А + + 2е, диссоциативная рекомбинация АВ + + е
А + + 2е, диссоциативная рекомбинация АВ + + е 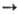 А + В и др.) обычно сравнительно быстро устанавливаются электронное равновесие, характеризующееся т-рой Т эл пост, и поступат. равновесие, характеризующееся т-рой Т а пост. Константа скорости ионизации атома А с точностью до слабо меняющегося предэкспоненциального множителя пропорциональна exp(-I/kT эл пост), где I-потенциал ионизации. Связь между Т кол и Т пост (или Т эл пост и Т а пост) определяется ур-нием баланса энергии каждой из подсистем, в к-ром учитывается их взаимод. и вклад подсистемы в энергетику р-ций. Электроны обмениваются энергией с колебаниями эффективнее, чем с поступат. и вращат. движениями, поэтому до установления полного равновесия в системе может наступить равновесие между электронной и колебат. подсистемами, выражающееся в равенстве Т кол = Т эл пост. Определяя Т эл пост, напр. по данным о свечении газа, можно косвенно оценить Т кол.
А + В и др.) обычно сравнительно быстро устанавливаются электронное равновесие, характеризующееся т-рой Т эл пост, и поступат. равновесие, характеризующееся т-рой Т а пост. Константа скорости ионизации атома А с точностью до слабо меняющегося предэкспоненциального множителя пропорциональна exp(-I/kT эл пост), где I-потенциал ионизации. Связь между Т кол и Т пост (или Т эл пост и Т а пост) определяется ур-нием баланса энергии каждой из подсистем, в к-ром учитывается их взаимод. и вклад подсистемы в энергетику р-ций. Электроны обмениваются энергией с колебаниями эффективнее, чем с поступат. и вращат. движениями, поэтому до установления полного равновесия в системе может наступить равновесие между электронной и колебат. подсистемами, выражающееся в равенстве Т кол = Т эл пост. Определяя Т эл пост, напр. по данным о свечении газа, можно косвенно оценить Т кол. Равновесное распределение колебат. энергии в двухатомном газе (молекулы АВ) при Т кол
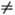 Т пост осуществляется путем быстрого (почти резонансного) обмена колебат. квантами по схеме: АВ n + АВ m
Т пост осуществляется путем быстрого (почти резонансного) обмена колебат. квантами по схеме: АВ n + АВ m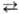 ABnb1 + АВ тb1 (индексами обозначены номера колебат. уровней). При таком обмене сохраняется общее число колебат. квантов, поэтому равновесие, к к-рому обмен приводит, характеризуется не только т-рой Т пост, но и хим. потенциалом m
ABnb1 + АВ тb1 (индексами обозначены номера колебат. уровней). При таком обмене сохраняется общее число колебат. квантов, поэтому равновесие, к к-рому обмен приводит, характеризуется не только т-рой Т пост, но и хим. потенциалом m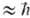 w0 (1 - Т пост/Т кол), где
w0 (1 - Т пост/Т кол), где 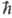 w0 = E1 - E0(w0- основная частота колебаний). Для колебат. уровней с энергиями <>i,> меньшими нек-рого значения <>i*> (номер уровня i
w0 = E1 - E0(w0- основная частота колебаний). Для колебат. уровней с энергиями <>i,> меньшими нек-рого значения <>i*> (номер уровня i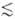 i*), обмен энергии внутри колебат. подсистемы происходит быстрее, чем между колебаниями и поступат. движением молекул. Заселенности <>i таких уровней определяются выражением
i*), обмен энергии внутри колебат. подсистемы происходит быстрее, чем между колебаниями и поступат. движением молекул. Заселенности <>i таких уровней определяются выражением 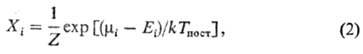
где
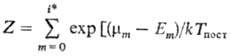 .
. Константа скорости диссоциации при этом выражается в виде
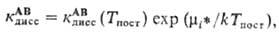
гдe к АВ дисс (Т пост )-значение к АВ дисс при Т кол = Т пост. Распределение (2) переходит в ф-лу Больцмана при Т кол = Т пост.
В бинарной газовой смеси двухатомных молекул АВ и CD с близкими частотами колебаний происходит быстрый обмен колебат. квантами при столкновениях как одинаковых, так и разных молекул. При этом устанавливается след. соотношение между колебат. т-рами Т кол АВ и Т колCD :
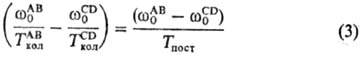 | Ещё
| Ещё