Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Растворимость
способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов (см. Растворы).Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Р. определяется физ. и хим. сродством молекул р-рителя и растворяемого в-ва, соотношением энергий взаимод. однородных и разнородных компонентов р-ра. Как правило, хорошо раств. друг в друге подобные по физ. и хим. св-вам в-ва (эмпирич. правило "подобное раств. в подобном"). В частности, в-ва, состоящие из полярных молекул, и в-ва с ионным типом связи хорошо раств. в полярных р-рителях (воде, этаноле, жидком аммиаке), а неполярные в-ва хорошо раств. в неполярных р-рителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная Р. неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V)1/2, где Е- теплота испарения, V-полярный объем. Параметр р-римости - одно из осн. понятий, определяющих когезион-ные св-ва в-в в конденсир. состояниях; важная технол. характеристика полимеров и р-рителей, лакокрасочных материалов и т. п. (см. Когезия). Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости р-рителя. Обычно более растворимы электролиты с большей склонностью к сольватации р-рителем; образование кристаллогидратов обычно увеличивает Р. солей.
Р. данного в-ва зависит от т-ры и давления соотв. общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип).Концентрация насыщ. р-ра при данных условиях численно определяет Р. в-ва в данном р-рителе и также наз. растворимостью. Пересыщенные р-ры содержат большее кол-во растворенного в-ва, чем это соответствует его Р., существование пересыщенных р-ров обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы).Для характеристики Р. малорастворимых в-в используют произведение активностей ПА (для р-ров, близких по своим св-вам к идеальному,-произведение р-римости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом т-ры Р. газов в воде уменьшается. В орг. р-рителях газы часто раств. с поглощением тепла и с ростом т-ры Р. газов повышается. В нек-рых случаях на кривых зависимости р-римости газов от т-ры наблюдается минимум (напр., система водород-вода). При постоянной т-ре в случае образования идеального разб. бинарного р-ра неэлектролита Р. газа (молярная доля в р-ре) пропорциональна его парциальному давлению над р-ром (см. Генри закон).С ростом давления для определения Р. газа необходимо учитывать отклонение его св-в от св-в идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость - жидкость (жидкие смеси) различаются по след. типам: жидкости смешиваются друг с другом во всех отношениях (напр., система вода - этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом т-ры взаимная Р. жидкостей в большинстве случаев увеличивается и, если не достигается т-ра кипения, существует т-ра, при к-рой обе жидкости смешиваются друг с другом в любых соотношениях,-т. наз. критич. т-ра р-римости, или верх. критич. точка смешения (ВКТС). Если достигается т-ра кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В нек-рых системах взаимная Р. повышается с понижением т-ры и возможно достижение ниж. критич. т-ры смешения (HKTС). Известны системы (напр., вода-трибу-тилфосфиноксид), где имеется и верхняя и нижняя критич. точки (см. Критическое состояние).Обычно область расслаивания жидкой смеси при понижении т-ры пересекается с линией ликвидуса с образованием монотектич. или синтек-тич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на Р. зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится меньше его парциального молярного объема, Р. в-ва с ростом давления снижается. Такая закономерность характерна для неполярных р-рителей; напр., Р. гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости Р. от давления имеется максимум. Для электролитов на зависимость Р. от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами р-рителя. Взаимная Р. жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
В-во, способное раств. в двух неограниченно смешивающихся друг с другом р-рителях, распределяется между ними так, что отношение его активностей в этих р-рителях а 1 и а 2 при постоянной т-ре остается постоянным, независимо от общего кол-ва растворенного в-ва: a1/a2 = К, где К- коэф. распределения (закон Бертло-Нернста). Для сильно разб. р-ров вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение т-ры приводит к увеличению Р. Если образуется идеальный р-р, зависимость Р. от т-ры записывается ур-нием Шредера
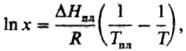 | Ещё
| Ещё