Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Реакционная Способность
,характеристика относительной хим. активности молекул, атомов, ионов, радикалов. Для количеств. оценки Р. с. рассматривают реакционные серии, т. е. ряды однотипных р-ций, проводимых в одинаковых условиях, напр.: (стандартная р-ция)
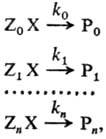
где Х-общая группа атомов, к-рая претерпевает изменения в данной р-ции (реакционный центр), Z0, Zl,..., <>n-> неизменяющиеся мол. фрагменты, Р 0, Р 1,..., Р n -продукты р-ции. Отношения констант скоростей k1/k0,..., kn/k>0 количественно характеризуют Р. с. в ряду реагентов ZiX (i =0, 1, ..., п). В правильно составленной реакц. серии изменение механизма реакции должно быть исключено, т. е. константы скорости должны характеризовать одну и ту же элементарную р-цию.
Типичные реакционные серии. Простейшая ситуация возникает при анализе изомерного состава продуктов р-ции. В р-ции электроф. замещения в ароматич. ряду в зависимости от заместителя R образуются те или иные изомеры, напр. при нитровании:
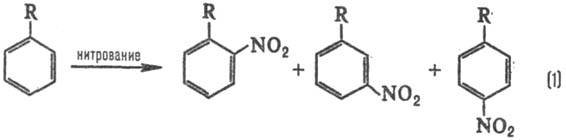
Электронодонорные заместители [R=СН 3, ОСН 3, N(CH3)2] стимулируют образование орто- и пара -продук-тов, а электроноакцепторные (R = СООН, SO3H, NO2)-мета -продуктов, причем в первом случае р-ция идет легче, чем с незамещенным бензолом (R = Н), а во втором-труднее. Эти закономерности наз. правилами ориентации в ароматическом ряду. При нуклеоф. замещении правила ориентации обращаются.
Стереохим. направленность перипиклич. р-ций определяется Вудворда-Хофмаиа правилами, напр.:
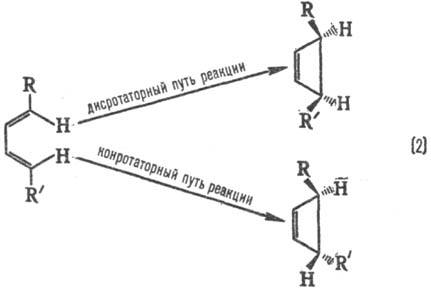
При дисротаторном пути р-ции заместители R и R' в продукте будут расположены по одну сторону плоскости цикла, при конротаторном пути-по разные стороны. Эксперимент показывает, что термич. циклизация производных бутадиена происходит по конротаторному пути, а фотохим. циклизация-по дисротаторному пути.
В примерах (1) и (2) нет необходимости в количеств. кинетич. измерениях, Р. с. определяется по относит. выходу изомеров. Пример широкой реакц. серии-р-ции радикального присоединения по двойной связи:
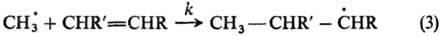
Р. с. характеризуется отношением константы скорости kк константе скорости k0 р-ции с этиленом (R, R' = Н) (см. табл.). Аналогичные кинетич. измерения сделаны для р-ций присоединения метильного радикала к ароматич. молекулам и для р-ций присоединения др. радикалов.

Квантовохимическая теория Р. с. Совр. теоретич. химия позволяет непосредственно рассчитать абс. константы скорости только для несложных хим. систем. В теории Р. с. качеств. закономерности м. б. выявлены для объектов любой сложности. При этом используют разл. подходы. При эмпирич. подходе классифицируют влияние заместителей по неск. типам (эффекты сопряжения, полярные, пространственные и др.) и применяют корреляционные соотношения. Традиц. квантовохим. подход основан на активированного комплекса теории; при этом предполагается, что для всех р-ций, составляющих реакц. серию (без пространств. и соль-ватац. эффектов), остается примерно постоянным пред-экспоненц. множитель Ав Аррениуса уравнении для константы скорости k = Aexp(<>./RT>)(R-газовая постоянная, Т-абс. т-ра). Поэтому характеристикой Р. с. служит энергия активации р-ции <>., к-рая практически совпадает с высотой потенц. барьера на поверхности потенциальной энергии (ППЭ).
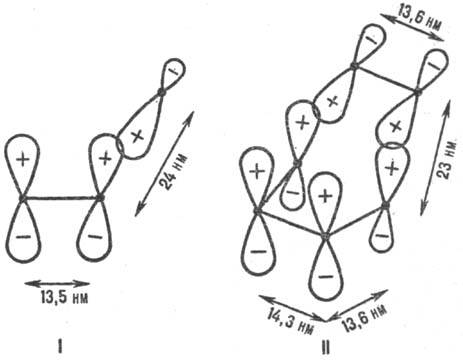
Рис. 1. Переходные состояния р-ций присоединения с участием p-электронных систем. I-радикальное присоединение (метальный радикал + этилен), II-р-ция Дильса-Альдера (этилен + бутадиен); внизу изображены соответствующие модельные p-сопряженные структуры. Показаны атомные 2pp -орбитали, асимметрия к-рых обусловлена изменением гибридизации вследствие взаимод. в переходном состоянии. Черные точки-ядра атомов С. Знаки " + " и " Ч" относятся к соответствующим волновым ф-циям. Орбитали перекрываются в фазе. Приведены межатомные расстояния в переходном состоянии.
Энергия стабилизации. Для относит. оценки <>. в реакц. сериях важна концепция делокализации электронов в переходном состоянии (активир. комплексе) р-ции (М. Эванс, 1939). Согласно этой концепции, электронное строение мн. реакц. центров подобно строению сопряженных открытых и циклических я-электронных систем (рис. 1). Открытое переходное состояние радикальной р-ции типа (3) подобно p-электронной системе аллильного радикала (рис. 1, I), а "циклическое" переходное состояние согласованной р-ции Дильса-Альдера (этилен + бутадиен) по строению напоминает бензол (рис. 1, И). p-Электроны заместителей R и R' включаются в общую делокализованную систему электронов. Относит. мерой энергии активации р-ции, а следовательно и Р. с., может служить энергия стабилизации переходного состояния (энергия делокализации), т. е. разность между энергией сопряженной системы p-электронов переходного состояния и энергией p-электронов в изолир. реагентах. Энергию стабилизации можно рассчитать полу-эмпирическими методами квантовой химии, напр. методом Хюккеля. Вычисляя энергию стабилизации, можно предсказывать Р. с. хим. соединения во мн. р-циях (иллюстрации см. на рис. 2).
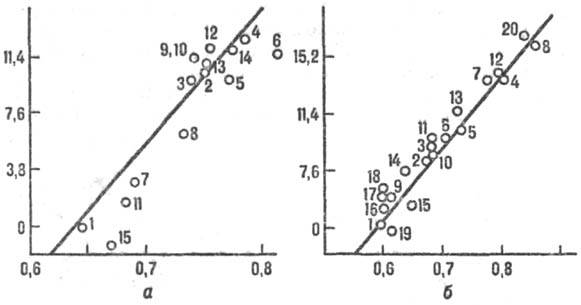
Рис. 2. Корреляция между реакц. способностью и энергией стабилизации переходного состояния, а-р-ции присоединения метального радикала СН Х3 к олефи-нам, цифры соответствуют номеру олефина в таблице. На оси ординат отложены величины 2,3 RТ lg k/k0 (кДж/моль), где k/k0 - отношение констант скорости рассматриваемой р-ции и р-ции с этиленом, R- газовая постоянная, Т-абс. т-ра. На оси абсцисс отложены энергии стабилизации в относит единицах, б-р-ция СН Х3 + ароматич. молекула. В скобках указано положение в молекуле субстрата, для к-рого приводится константа k. k0- константа скорости р-ции с бензолом. 1-бензол; 2-нафталин (1); 3-фенантрен (9); 4-антрацен (9); 5-пирен (1); 6-хризен (6); 7-бенз(а)антрацен (7); 8-нафтацен (5); 9-пиридин (2); 10-хино-лин (4); 11 -изохинолин (1); 12-акридин (9); 13-феназин (1); 14-бензонитрил (4); 15-ацетофенон (4); 16-фторбензол (4); 17-хлорбензол (4); 18-бромбензол (4); 19-анизол (4); 20-бензохинон.
Концепция граничных орбиталей. Оценки Р. с. особенно просты, если использовать возмущений теорию. В распространенном варианте теории возмущений энергия стабилизации представляется в виде суммы вкладов от взаимод. между мол. орбиталями реагентов. Наиб. вклад в сумму дают, как правило, взаимод. граничных орбиталей, т. е. высших заполненных электронами и низших незаполненных орбиталей; согласно К. Фукуи (1952), существенны только эти вклады (см. Граничных орбиталей теория). Концепцию граничных орбиталей часто применяют в качестве основы для обсуждения Р. с.
Альтернантные системы. Качеств. подход, не обязательно использующий теорию возмущений, сформулирован для класса сопряженных систем, наз. альтернант-ными. Они образованы из одинаковых атомов (обычно углерода) и не содержат нечетных циклов (см. Альтернантные углеводороды).Для таких систем в рамках Хюккеля метода можно без всяких вычислений выявить нек-рые общие закономерности. Так, введение полярного заместителя приводит к чередованию положит. и отрицат. изменений электронной плотности в сопряженной углеродной цепи относительно незамещенного углеводородного соед. (закон альтернирующей полярности, Ч. Коул-сон, Г. Лонге-Хиггинс, 1947). Этот вывод теории позволяет объяснить правила ориентации в ароматич. ряду (р-ция 1).
| Ещё