Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Серы Триоксид
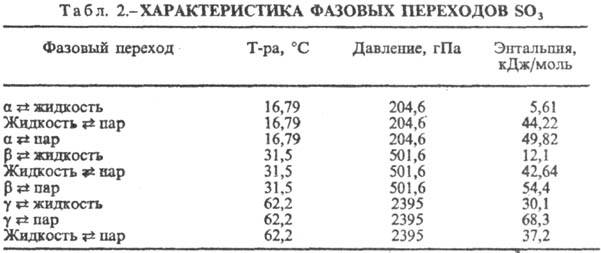
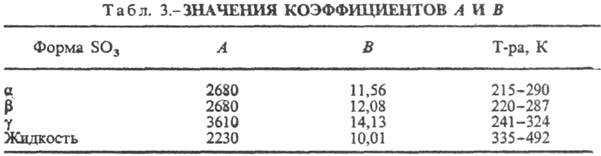
(серный ангидрид) SO3, мол. м. 80,066; бесцв. жидкость; молекула имеет треугольную конфигурацию с атомом S в центре, длина связи SЧО 0,1418 нм, расстояние ОЧО 0,248 нм, угол OSO 120,0°, m = 0; т. кип. 44,7 °С; t крит 218,3 °С, p крит8,2 МПа, d крит 0,633 г/см 3 (см. также табл. 1); диэлектрич. проницаемость 3,11 (18°С); ниже 16,79 °С-прозрачные кристаллы, структура к-рых построена из кольцевых молекул (SO3)3, кристаллич. решетка ромбическая (a-SO3, а= 1,07 нм, b -1,93 нм, с =5,30 нм, z = 12, пространств, группа Рпа2).В присут. следов влаги (~ 1 моль Н 2 О на 106 молей SO3) С. т. полимеризуется с образованием вначале b-SО 3 -бесцв. шелковистые асбестоподобные кристаллы моноклинной сингонии, их структура состоит из длинных зигзагообразных цепей ЧSO2 ЧОЧSO2 Ч, на концах к-рых имеются группы ОН. При дальнейшей полимеризации b-форма переходит в др. моноклинную модификацию g, в структуре к-рой указанные выше цепи объединены в плоские сетки. Получена и d-форма (цепи объединены в объемные структуры), ее т. пл. 95 °С (под давлением). g-SO3 при нормальном давлении не плавится, а возгоняется. Сведения о фазовых переходах С. т. даны в табл. 2. Ур-ние температурной зависимости давления пара 1gр(гПа) = Ч А/ Т+ В, значения коэф. приведены в табл. 3. В парах в осн. присутствуют молекулы SO3, в небольшом кол-ве-(SO3)3.
Переходы a : b, b : g, g : d происходят медленно, b-форма м. б. превращена в a только через паровую фазу (в отсутствие влаги) при конденсации паров ниже 16,8°С. Термич. диссоциация SO3 : SO2 + О 2 начинается ок. 450 °С, при 1200 °С становится практически полной. С. т. дымит на воздухе, с водой бурно реагирует с образованием H2SO4 и выделением большого кол-ва тепла. Раств. в конц. H2SO4, р-р наз. олеумом. Энергично реагирует с основаниями, основными оксидами, солями, давая сульфаты. С НС1 образует хлорсульфоновую к-ту HSO3Cl, с HF-HSO3F. С. т.-сильный окислитель, окисляет S, P, углеводороды и др., восстанавливаясь до SO2. Реакц. способность увеличивается в ряду d <g <b <a.
О пром. произ-ве С. т. см. Серная кислота. В лаборатории С. т. получают прокаливанием Fe2(SO4)3 или Na2S2O7. Транспортируют жидкий С. т., его полимеризацию предотвращают введением Р 2 О 5, В 2 О 3 и др. Перевозят С. т. в цистернах из малоуглеродистой стали. С. т.-промежут.

продукт в произ-ве серной к-ты и олеума. Его используют также для получения HSO3C1, SeO3, SO2C12 и др., как сульфирующий агент, для дегидратации при- получении безводной азотной к-ты.
С. т. токсичен, поражает слизистые оболочки и дыхат. пути, вызывает тяжелые ожоги кожи, ПДК в воздухе рабочей зоны 1 мг/м 3. И. Н. Один.