Поиск по словарю Химический словарь
-
В закладки
 В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.
В закладки будет добавлено толкование к данному слову в данном словаре. Закладки сохраняются на Вашем компьютере в cookie. Если Ваш браузер не поддерживает cookie или такая возможность отключена, то сохранение закладок будет не возможно.Сульфиды Органические
(тиоэфиры), соед. общей ф-лы RSR', где R и R'-opг. остатки; атом S может входить в цикл.
Наиб. часто С. о. называют, прибавляя суффикс "сульфид" к названию орг. радикалов, напр. СН 3SС 2 Н 5 -метилэтил-сульфид, (С1СН 2)2S- бис -(хлорметил)сульфид. В полифунк-цион. соединении группу RS называют органилтио-, напр. C2H5S(CH2)2COOH-3-(этилтио)пропионовая к-та. Используют также заменительную номенклатуру, напр. СН 3SСН 2SСН 3-2,4-дитиапентан. Циклические Со. называют по правилам наименования гетероциклических соединений. Иногда употребляют систематич. и тривиальные назв. кислородсодержащих соед. с префиксом "тио", напр. тиооксид этилена, тиоанизол и т. п. Особую номенклатуру применяют в Chemical Abstracts, напр. (СН 3)2S-тиобисме-тан, Ph2S -1,1 -тиобензол.
В природе С. о. содержатся в неочищенной нефти в качестве примесей, нек-рые С. о.-биологически активные прир. соединения, напр. метионин.
Низшие алифатические С. о.-подвижные бесцв. жидкости; не раств. в воде, хорошо раств. в орг. р-рителях. Технические С. о. обладают неприятным запахом, чистые-без запаха. С. о. кипят выше своих кислородных аналогов-простых эфиров.
В ИК спектрах С. о. наблюдаются валентные колебания связей RЧS в области 570-705 см -1 (при R = Alk-слабые полосы, при R = Ar, винил-полосы средней интенсивности). Фрагмент CH3S дает характерную полосу поглощения при 1325 см -4 (деформац. колебания связи СЧН). В УФ спектрах алифатических С. о. присутствуют полосы поглощения 200, 220 и 240 нм, для алкиларилсульфидов 205-230, 235-270, 275-300 нм, обусловленные переходами n: s*.
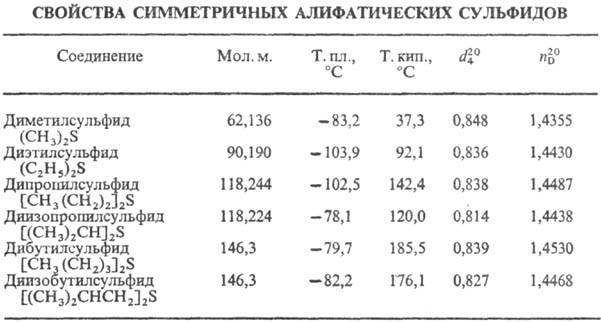
Длина связи СЧS ок. 0,18 нм для насыщ. алифатических С. о. и ок. 0,175 нм для диарилсульфидов. Валентный угол между связями RЧSЧR' возрастает с увеличением объема заместителей R и R' и составляет, напр., при R = R' = СН 3 98,9°, R = R' = Ph 109°, R = R' = CF3 105,6°, R = CH3, R' = C(SCH3)3 118,5°.
Реакции по атому S. Co.-более слабые основания, чем простые эфиры, но обладают большей нуклеофиль-ностью. С разл. электроф. реагентами (к-ты Льюиса, соли тяжелых металлов) образуют донорно-акцепторные комплексы. Р-ция С. о. с алкилиодидами, диалкилсульфатами и алкилсульфонатами, а также со спиртами в присут. к-т приводит к солям сульфония (см. Сульфониевые соединения),напр.: RR'S + R:X:[RR'SR:]+X-. С. о., содержащие ви-нильную или арильную группу либо Hal, или др. электро-ноакцепторную группу в a- и даже b-положениях, менее склонны к комплексообразованию.
С. о. окисляются Н 2 О 2 в ледяной СН 3 СООН или ацетоне, а также орг. надкислотами в эквимолярных кол-вах до сульфоксидов, при избытке этих же окислителей или при действии KMnO4, HNO3 и т. п. образуются сульфоны. Окисление арилалкилсульфидов Сl2 или Вr2 в присут. Н 2 О используют для получения ароматич. сульфонилгалогени-дов:
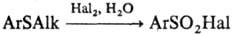
Фотоокисление бензилалкилсульфидов сопровождается расщеплением связи SЧбензил:
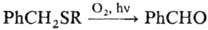 + RS(O)SR или RS(O2)SR.
+ RS(O)SR или RS(O2)SR. Окислит. фторирование С. о. действием F2, XeF2, C1F и т. п. приводит к образованию RR'SF2 или RR'SF4, к-рыге при гидролизе дают соответствующие сульфоксиды и сульфоны.
Реакции С. о. по органическим радикалам. Атом S в орг. соединении стабилизирует карбанионы, карбка-тионы и радикалы в a-положении; повышает СН-кислот-ность соед., к-рая возрастает по мере накопления геми-нальных RS-групп. С. о., содержащие a-H-атом, при взаимод. с RLi образуют устойчивые в р-ре Li-производные, напр.: RSCH3 + C4H9Li : RSCH2Li+. a-Алкил(арил)тиоза-мещенные соед. легко вступают в р-ции с участием карб-анионов, напр.:
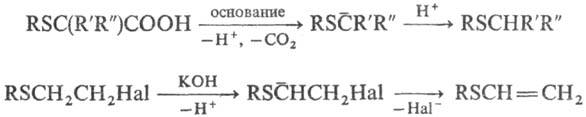
Аллилсульфиды подвергаются анионотропной изомеризации в пропенилсульфиды:
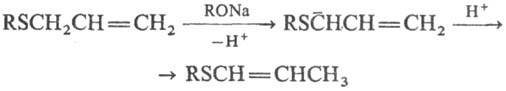
При действии галогенирующих агентов на алифатич. сульфиды происходит замещение a-H-атомов на галоген, напр.:
(CH3)2S : CH3SCH2Cl : CH3SCHCl2 : CH3SCCl3 : : C1CH2SCCl3 : Cl2CHSCCl3
При дальнейшем хлорировании расщепляются связи СЧS. a-Хлор диалкилсульфиды-активные алкилирующие агенты. Под действием оснований (NaOH или трет- бутилат К) a-H-a-галогенсульфиды образуют алкилтио- и арилтиокар-бены, фиксируемые разл. способами:
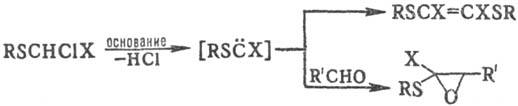
Гидролиз a-галогенсульфидов протекает по механизму <>Nl до тиола, альдегида и HHal; a,a-дигалогендиалкил-сульфиды гидролизуются до эфиров тиолкарбоновых к-т:
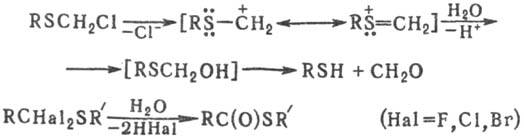
Для С. о., содержащих галоген в b-положении, характерны р-ции нуклеоф. замещения (промежуточно образуются эпи-сульфониевые соли):
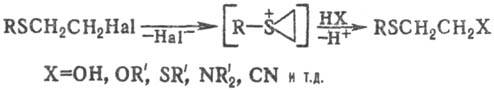
a, b-Ненасыщенные С. о. вступают в реакции электроф. присоединения, а также в радикальные реакции; винил-сульфиды способны к реакциям электроф. замещения b-H-атомов, напр.:
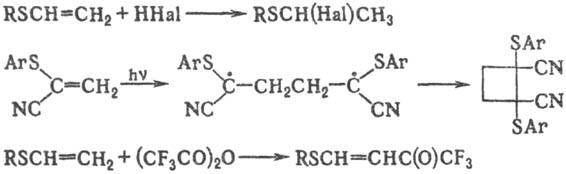
В ароматич. ядре группа RS активирует кольцо в р-циях электроф. замещения и ориентирует вступающие заместители в орто- и пара -положения.
Реакции с расщеплением связи С Ч S. Восстановители (LiAlH4, NaBH4, Na в жидком NH3 и др.) расщепляют С. о. по схеме: RSR' : RSH + R'H. Легкость расщепления зависит от природы орг. радикала (R') и уменьшается в ряду: алкинил > винил ! аллил > алкил, а при R' = Alk в ряду: третичный > вторичный > первичный. Расщепление дибен-зилсульфидов под действием оснований сопровождается в зависимости от условий перегруппировками Соммле или Стивенса:
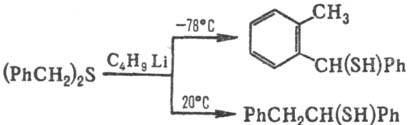
При действии электроф. реагентов (к-т, На12, HalCN и т. п.) образуются производные S(II), напр.:
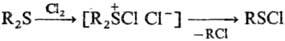
В случае несимметричных С. о. отщепляется тот радикал, к-рый образует наиб. стабильный карбкатион. В препаративных целях в качестве уходящей группы чаще всего используют бензильную группу. Известно фотохим. и термич. расщепление С. о., напр.:
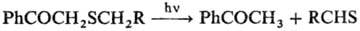 | Ещё
| Ещё